重要なお知らせ
日常臨床におけるアルドステロン測定標準化に関する運用指針(第三版)
—NonRIAキットによるSpac-S(RIA)キットの供給停止に向けた対応についてー
日本内分泌学会
アルドステロン測定の標準化検討委員会
本公告は、前回の「日常臨床におけるアルドステロン測定標準化に関する運用指針(第二版)1)」についての続報であり、今回実施した互換性確認試験結果と今後の対応について示したものである。
原発性アルドステロン症のスクリーニングに適用されている診断基準は、わが国ではSpac-S(RIA)キットを用いて得られた数値で定められている2,3)。
一方、多数の検体処理に向けてnonRIA法による測定技術が開発されてきた現状において、特に原発性アルドステロン症(PA)のスクリーニングでは、用いる測定法やキットにより判断が異なる可能性が危惧されていた。
そこで日本内分泌学会では、日常臨床におけるアルドステロン測定の標準化を目的として、「アルドステロン測定の標準化検討委員会」を設置して基礎検討を行ってきた。その結果、国立研究開発法人 産業技術総合研究所において、アルドステロン濃度測定の基準測定操作法のID-LC-MS/MSを設定し、これを用いて認証値を決定した「アルドステロン分析用ヒト血清(NMIJ CRM 6402)」の認証標準物質を設定している4, 5)。これにより、測定体系としての計量学的トレーサビリティが整備され、臨床検体の測定値は、SI(国際単位)にトレーサブルな測定値が得られることになった。すなわち、本認証標準物質は、指定比較対照法のLC-MS/MSおよびnonRIA法のキットの校正に用い、キットの患者検体測定値の妥当性の評価を同時に測定したLC-MS/MS値に対して行うことが可能となりさらにキット間の測定値の互換性の確保が容易となった。
今般、標準化された測定法を中心にキットによる測定値の互換性確認試験を実施し、併せてPAのカットオフ値の比較を行ったので、その結果の概要と今後の対応について示す6)。
1. キットの認証状況
アルドステロン測定用キットの認証状況を図1に示した。認証はクラスⅡ分類で行われ、先発キットのSpac-S(RIA)とこれに対する相関試験によるものが2社2キット(CLEIA)および標準化された測定体系に基づいて認証標準物質による校正およびLC-MS/MSとの相関によるものが2社3キット(CLEIA)である。
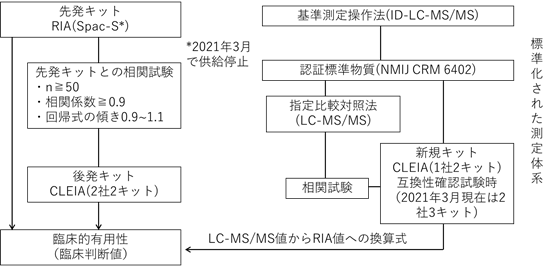
図1 アルドステロン測定用キットの体外診断用医薬品(IVD)の認証の現状:クラスⅡ分類
2. 互換性確認試験の実施概要
血中アルドステロン測定の互換性確認試験の実施概要を図2に示した。患者検体は濃度分布を考慮した75件を用いた。参加測定法は、指定比較対照法(designated comparison method : DCM)のLC-MS/MSと測定キットのRIA値グループが3種、標準化されたキットのMS値グループが4種であった6)。測定は2020年10月に実施した。

図2 血中アルドステロン測定の互換性確認試験の実施概要
3. LC-MS/MSに対するPassing-Bablokによる回帰分析
各キットについて指定比較対照法のLC-MS/MSに対する回帰分析結果を表1に示した。
表1 指定比較対照法(DCM)(NMIJ CRM 6402校正によるLC-MS/MS)に対する
Passing-Bablokによる回帰分析結果
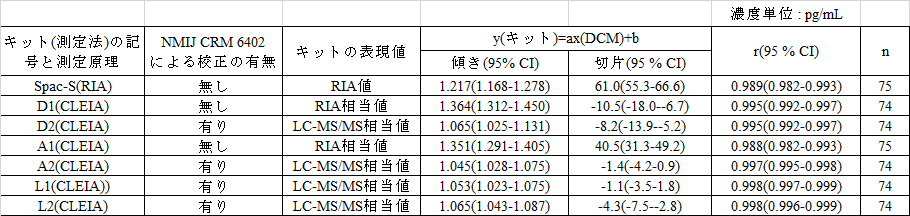
その結果、DCMに対するRIA値グループのSpac-S、 D1およびA1の回帰結果は、とくに切片が異なった。一方、標準化されたMS値グループのD2, A2, L1およびL2の回帰分析結果は、近似していた。
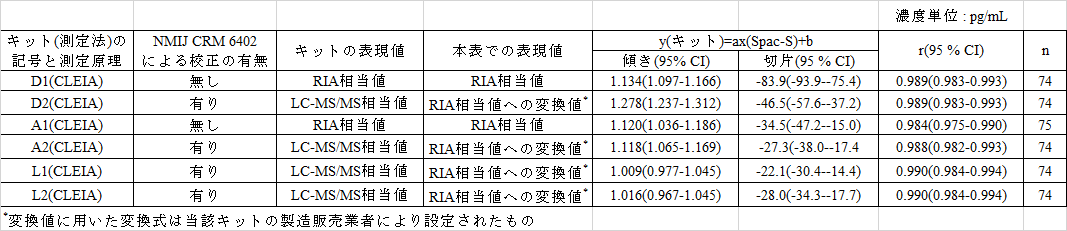
4. Spac-Sに対するPassing-Bablokによる回帰分析
Spac-Sに対する回帰分析結果を表2に示した。その結果、Spac-Sに対してはRIA値グループおよびMS値グループともに回帰分析結果は異なった。
表2 RIAのSpac-Sに対するPassing-Bablokによる回帰分析結果
5. PAC 120 pg/mLに対するLC-MS/MS値の比較
Spac-SによるPAの臨床判断値のPAC 120 pg/mLに対するLC-MS/MS値およびLC-MS/MS相当値(MS相当値)とRIA換算値を表1の結果に基づいて算出して比較したのを図3に示した。
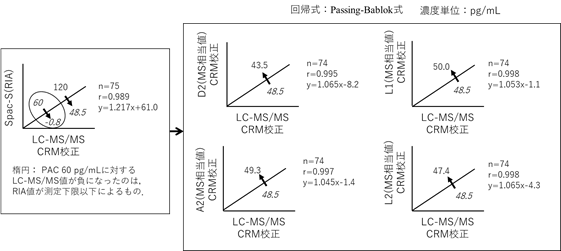
図3 互換性確認試験結果:LC-MS/MS値およびLC-MS/MS相当値(MS相当値)
―臨床判断値の比較(PAC 120 pg/mL) ―
CRM校正:認証標準物質NMIJ CRM 6402による校正
その結果、LC-MS/MSとSpac-Sと相関式を用いてSpac-S値の120 pg/mLに対応するLC-MS/MS値は48.5 pg/mLであった(図3の左上)。なお、Spac-Sの60 pg/mLに対応するLC-MS/MS値が-0.8 pg/mLになったことは、RIA値が測定下限以下になっていたことによる。また、標準化されたMS値グループのD2、A2、L1、およびL2は、LC-MS/MS値の48.5 pg/mLに対応する値として当該の回帰式から計算したもので、いずれも近似した結果となりキット間の互換性は維持されていた。
6. PAC 120 pg/mLに対するRIA値の比較
Spac-SによるPAの臨床判断値のPAC 120 pg/mLに対するRIA相当値とRIA換算値を表2の結果に基づいて算出して比較したのを図4に示した。また、PAC 60 pg/mLについても同様に比較した。
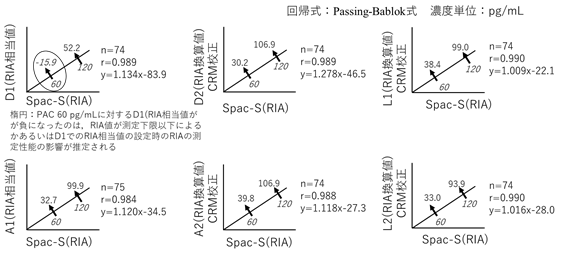
図4 互換性確認試験結果:RIA値、RIA相当値およびRIA換算値
―臨床判断値の比較 (PAC 60 pg/mL, PAC 120 pg/mL) ―
CRM校正:認証標準物質NMIJ CRM 6402による校正
その結果、RIA値グループのD1とA1では、Spac-S値の60 pg/mLおよび120 pg/mLに対応するRIA相当値は異なり、約2倍の差があった。これに対して標準化されたMS値グループのD2、A2、L1およびL2 では、Spac-S値の60 pg/mLおよび120 pg/mLに対応するRIA相当値は近似した結果となり、キット間の互換性は維持されていた。
なお、Spac-S値の60 pg/mLに対応するD1値が負となったことは、RIA値が測定下限以下によるかあるいはD1でのRIA相当値の設定時のRIAの測定性能の影響が推定される。
7. 測定法間の臨床判断値の比較
互換性確認試験による判断値についての図3および図4と前回の検討結果7)を用いて算出した結果を合わせた測定法間の臨床判断値を比較した結果を図5に示した。
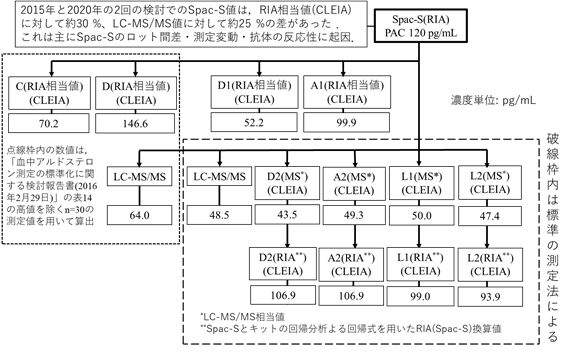
図5 測定法間の臨床判断値の比較
その結果、今回の検討では、Spac-Sの120 pg/mLに対応する標準化された測定法のLC-MS/MS値とLC-MS/MS相当値およびこれらの値からのRIA換算値は、それぞれ近似した結果となった。しかし、これら以外のRIA相当値のD1およびA1では約2倍の差があった。この差の程度は、前回の検討結果を用いた比較でも同様に約2倍の差があった(図5の左上の点線の枠内)。さらにこれらのD1とA1のRIA換算値は約30 %の差があった。
一方、前回の検討でのSpac-S値とキット(CおよびD)のRIA相当値と今回の検討でのSpac-S値とキット(D1およびA1)のRIA相当値について、比としてのD1(RIA相当値)/C(RIA相当値)およびA1(RIA相当値)/D(RIA相当値)はいずれも0.7であった。このことは少なくともこれらのRIA相当値の2社のキット間(CとD1およびDとA1)での測定性能は維持されていたことになる。
さらに、LC-MS/MS値においてもSpac-Sの120 pg/mLに対応する換算値は、今回と前回の値の比から約25 %の差がそれぞれ生じていた。これらの差が生じた主な要因は、Spac-Sのロット間差、測定変動および抗体の反応性に起因していることが推定される。
Spac-SにPAC 120 pg/mLのnonRIAでの対応値は、RIA相当値の2キットでは異なったが、LC-MS/MS値およびLC-MS/MS相当値の4キットでは近似した値となり、LC-MS/MS相当値の4キット(D2、A2、L1およびL2)での平均値は47.6 pg/mLであった。また、これら4キットのLC-MS/MS相当値から当該キットの製造販売業者による換算式で換算したRIA換算値の平均値は101.7 pg/mLであり、近似した結果となった。
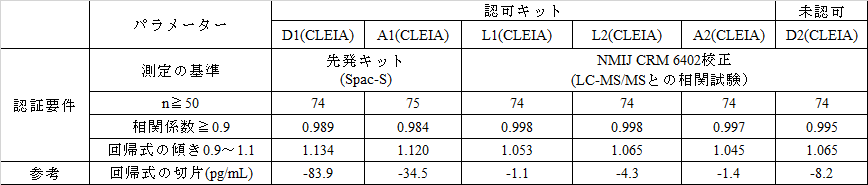
互換性確認試験でのキットの認証要件に対する結果の比較を表3に示した。
D1とA1のキットは、認証要件は同一ではあるが、認証時期が異なる。しかし、認証要件には規定されていないが、回帰式切片が約2倍異なることが両キットで差が生じた主な理由と思われる。これに対して認可キットのL1、L2、A2および未認可のD2はいずれも標準化キットであり、認証要件を満たしているほか、回帰式の切片が小さく、キット間差がないことがわかる。
表3 互換性確認試験でのキットの認証要件に対する結果の比較
さらに、CLEIAとSpac-SおよびLC-MS/MSとの関係を文献で確認した結果およびSpac-SによるPAC 120 pg/mLに対する計算値を表4に示した。回帰式2)から7)式のCLEIAは、表3の測定法の記号では、2)式はA1、3)式および4)式はL1、5)式および6)式はA2になる。また、7)式のCLEIA-newは5)式および6)式のCLEIAと同一であり、CLEIA-currentは2)式のCLEIAと同一である。
表4 RIA値とnonRIA値の主な関係式およびPAC診断値の比較
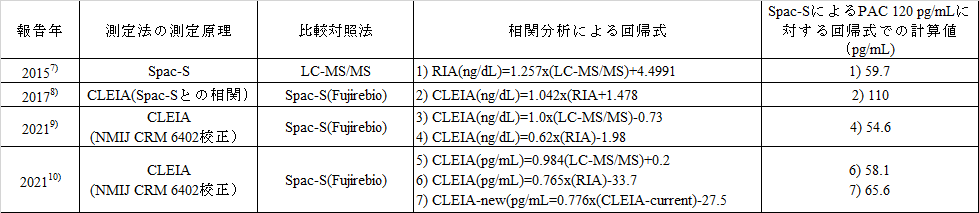
その結果、式1)では、Spac-SによるPAC 120 pg/mLに対応するLC-MS/MS値は59.7 pg/mLであった。さらに、回帰式2)から7)のCLEIAについて、Spac-SによるPAC 120 pg/mLの計算値(回帰式のRIAに代入して得た値)は、回帰式の2)式、4)式および6)式について順に110 pg/mL、54.6 pg/mLおよび58.1 pg/mLとなった。また、7)式のCLEIA-currentの項にPAC 120 pg/mLを代入した結果は65.6 pg/mLとなった。6)式と7)式の差が10 %程度であったことから、当該のCLEIAのキットは、測定性能は継続されていることを示している。
以上からLC-MS/MS値およびLC-MS/MS相当値について、Spac-SによるPAC 120 pg/mLに対する換算値の範囲は43.5~65.6 pg/mLになった。この幅は、回帰式を設定した際のSpac-S値による測定値が異なることによる影響であることが強く示唆された。
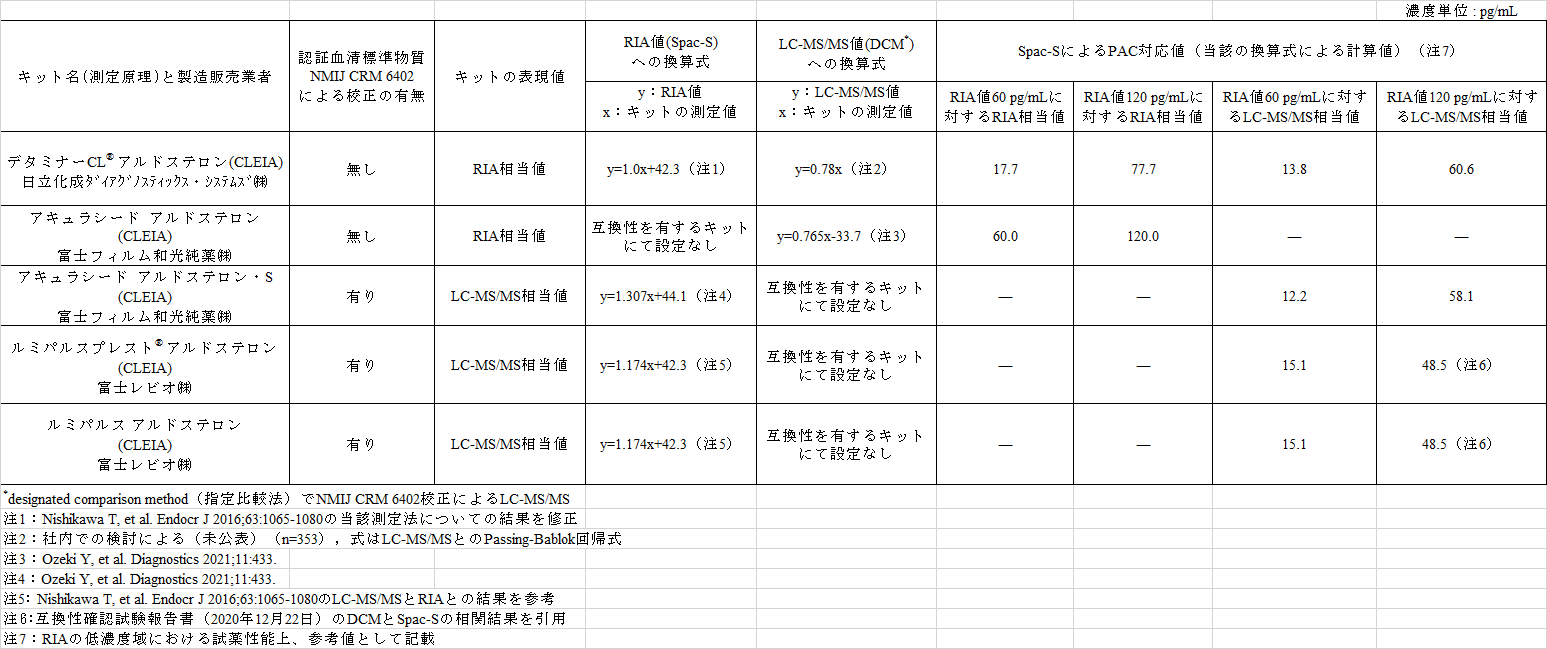
8. 製造販売業者が設定した換算式とRIAによるPAC対応値
2021年2月現在で認可されているnonRIAによるキットについて、Spac-SによるPAC値に対する換算式と対応値の結果を表5に示した。表5は、これまでの検討結果および当該キットの製造販売業者における検討や共同研究などにより製造販売業者が設定したもので、検討委員会から当該の製造販売業者に対して要請して得たものである。
表からも明らかなようにSpac-SによるPAC対応値は、RIA相当値ではとくに回帰式の切片に依存したキット間差が生じている。これに対してLC-MS/MS相当値ではキット間差はわずかで、互換性がある。
CLEIAによるキットとSpac-Sとの回帰式は、検討したときのSpac-Sの測定値の影響を受けていたが、その際に設定した関係式は、当該キットでは維持されていることから、キットによる測定値をPAの診断値に適用する場合は、現時点では当該キットの製造販売業者の指示に従うことになる。
一方、標準化されたキットでは、測定値の互換性は確保されていることが確認できた。しかし、Spac-S値によるPAC 120 pg/mLに対応する値については、当初設定したPAC 120 pg/mLと今回の検討で得られたPAC 120 pg/mLは、同質でない可能性が高く、少なくとも約30 %の差を有している。
表5 認可されているキット(2021年2月現在)の製造販売業者が設定した換算式とRIAによるPAC対応値
まとめ
今回の検討結果から以下のごとくまとめられる。
- 標準化作業により設定された測定体系の下でのLC-MS/MS値およびCLEIAによるキットのLC-MS/MS相当値には、互換性があることが確認できた。
- 標準化以前のCLEIAによる2キット間では、約2倍の差があり、互換性は確認できなかった。しかし、それぞれのキットでの継続性は確保されていた。
- Spac-Sの測定は、ロット間差、測定変動および抗体の反応性に起因して測定値に影響を与えていたことが推定された。
- PAC 120 pg/mLのnonRIAでの対応値は、RIA相当値の2キットでは異なったが、標準化によるLC-MS/MS値およびLC-MS/MS相当値の4キットでは近似した値となり、LC-MS/MS相当値の4キットでの平均値は47.6 pg/mLであった。また、これら4キットのLC-MS/MS相当値から換算したRIA換算値の平均値は101.7 pg/mLであった。
臨床判断値に対する今後の対応
PA診断値への対応概要案を図6に示した。すなわち、Spac-Sの供給停止に伴う臨床判断値(PAC 120 pg/mL)の対応については、以下のごとくになる。
- 現状のCLEIAによる2キットのRIA相当値は、キット間差があるが、臨床判断値の取り扱いは、当該キットの製造販売業者が指定する換算式による。
- 標準化されたCLEIAによる4キット(このうち認証キットは現在2社3キット)によるLC-MS/MS相当値の平均値が50 pg/mL程度であるが、これにはSpac-S値の変動の影響を含んでいる。しがって、PAの臨床判断値は、標準化されたキットによるLC-MS/MS相当値について、臨床評価試験を実施して再確認する必要がある。
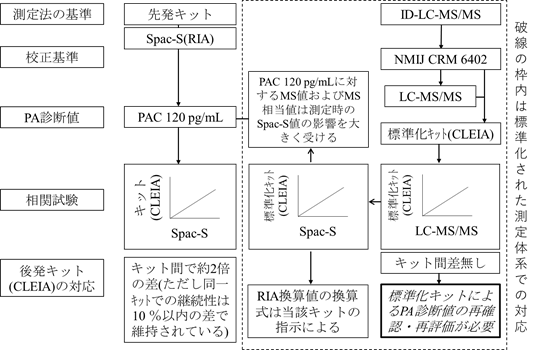
図6 PA診断値への対応概要案
文献
1) 日本内分泌学会アルドステロン測定の標準化検討委員会.
日常診療におけるアルドステロン測定標準化に関する運用指針(第二版).
2) Nishikawa T, Omura M, Satoh F, Shibata H, Takahashi K, Tamura N, Tanabe A. Guidelines for the diagnosis and treatment of primary aldosteronism -The Japan Endocrine Society 2009-. Endocr J 2011; 58,711-721.
3)日本内分泌学会.日本内分泌学会臨床重要課題「わが国の原発性アルドステロン症の診 療に関するコンセンサス・ステートメント」. 2016 年.
(http://www.shindan.co.jp/books/index.php?menu=02&cd=227300&kbn=1)
4) Nishikawa T, et al. Calibration and evaluation of routine methods by serum certified reference material for aldosterone measurement in blood. Endocr J 2016; 63, 1065-1080.
5) NMIJ CRM 6402:アルドステロン分析用ヒト血清(3濃度レベル)
(https://unit.aist.go.jp/qualmanmet/refmate/crm/cert/6402b_J.pdf)
6) 血中アルドステロン測定の互換性確認試験報告書. 2020 年12月22 日.
7) Satoh F, et al. Measurement of peripheral plasma 18-oxocortisol can discriminate unilateral adenoma from bilateral diseases in patients with primary aldosteronism. Hypertention 2015;65. Online Data Supplement.
8) Morimoto R, et al. Rapid screening of primary aldosteronism by a novel chemiluminescent immune assay. Hypertens 2017; 70:334-341.
9) Teruyama K, et al. Novel chemiluminescent immunoassay to measure plasma aldosterone and plasma active renin concentrations for the diagnosis of primary aldosteronism. J Human Hypertens 09 Feb 2021.
10) Ozeki Y, et al. Development of a new chemiluminescent enzyme immunoassay using a two-step sandwich method for measuring aldosterone concentrations. Diagnostics 2021; 11:433 (https://doi.org/10.3390/diagnostics11030433).

